10. КОРРОЗИЯ И КОРРОЗИОННОСТОЙКИЕ МАТЕРИАЛЫ
(Ю.П. Солнцев)Коррозией называют разрушение материалов под влиянием окружающей среды в результате ее химического или электрохимического воздействия (коррозия происходит от латинского слова «corrodere» разъедать, разрушать).
Обычно рассматривают коррозию металлических материалов. Однако это явление характерно не только для металлов и сплавов, аналогичные процессы могут происходить и в неметаллических материалах пластмассах, керамике. Примером такого воздействия может служить износ футеровки плавильных печей под действием жидкого, химически активного шлака.
Ущерб, причиняемый коррозией, может быть прямым и косвенным. Прямой ущерб включает в себя стоимость замены подвергшихся коррозии частей машин, трубопроводов, устройств. Для восстановления пораженных коррозией оборудования и конструкций ежегодно расходуется не менее 10 % продукции мирового металлургического производства.
Косвенный ущерб от коррозии связан с простоем оборудования в результате аварий, ухудшением качества продукции, например в результате ее загрязнения, увеличением расхода топлива, материалов, энергии. Так, при выходе из строя химической аппаратуры не выпускается продукция, отказ в работе двигателей приводит к простою ценного оборудования, нарушение герметичности газо- и нефтепроводов делает возможным утечку ценного сырья. Если в результате коррозии водопроводной системы прекращается подача воды на завод, то ремонт водопровода будет стоить во много раз меньше, чем расходы, связанные с остановкой завода на несколько часов. В зависимости от страны и климатических условий суммарный ущерб, наносимый коррозией, достигает уровня 310 % валового продукта.
Проникновение в результате коррозии газа, нефти и других продуктов в окружающую среду приводит не только к материальным потерям, но и к угрозе жизнеобеспечения человека и природы. Если ущерб от замены и ремонта оборудования можно хотя бы рассчитать, то ущерб окружающей среде не поддается расчету.
В зависимости от свойств окружающей среды и характера ее физико-химического воздействия на материал различают:
1) химическую коррозию, обусловленную воздействием сухих газов, а также жидкостей, не являющихся электролитами (нефть, бензин, фенол);
2) электрохимическую коррозию, обусловленную воздействием жидких электролитов: водных растворов солей, кислот, щелочей, влажного воздуха, грунтовых вод, то есть растворов, содержащих ионы и являющихся проводниками электричества.
Химическая коррозия. Наиболее распространенным видом химической коррозии является газовая коррозия (особенно усиливающаяся при высоких температурах), т. е. процесс взаимодействия с кислородом или активными газовыми средами (галоиды, сернистый газ, сероводород, пары серы, диоксид углерода и т. д.). При газовой коррозии разрушаются такие ответственные узлы и детали, как лопатки газовых турбин, сопла реактивных двигателей, арматура печей.
В производственных условиях чаще всего сталкиваются с окислением металлов, в случае сплавов на основе железа с образованием окалины. Защитные свойства металлов от окисления обусловлены образованием сплошных оксидных пленок на их поверхности. Для обеспечения сплошности пленок необходимо, чтобы объем оксида Vок был больше объема металла Vмет, из которого он образовался: Vок / Vмет > 1. В противном случае получается прерывистая пленка, не способная эффективно защитить металл от коррозии. Такая пленка характерна для магния (Vок / Vмет = 0,79), что затрудняет защиту сплавов на его основе от коррозии.
Помимо сплошности, оксидные пленки должны обладать высокими механическими свойствами, хорошо сцепляться с металлом и иметь достаточную толщину, обеспечивающую высокие защитные характеристики. Этим требованиям удовлетворяет пленка оксида хрома Cr2O3, что обусловливает высокую устойчивостъ против коррозии сталей и жаростойких сплавов с высоким содержанием хрома.
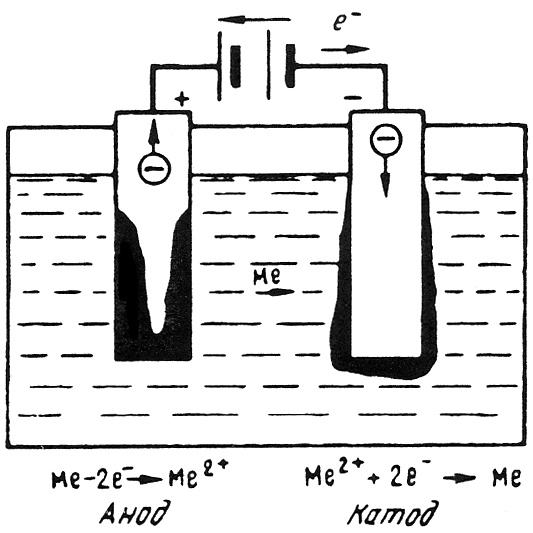
Электрохимическая коррозия наиболее распространенный вид коррозии металлов. При электрическом контакте двух металлов, обладающих разными электродными (электрохимическими) потенциалами и находящихся в электролите, образуется гальванический элемент. Поведение металлов зависит от значения их электродного потенциала. Металл, имеющий более отрицательный электродный потенциал (анод), отдает положительно заряженные ионы в раствор и растворяется (рис. 10.1). Избыточные электроны перетекают по внешней цепи в металл, имеющий более высокий электродный потенциал (катод). Катод при этом не разрушается, а электроны из него удаляются во внешнюю среду. Чем ниже электродный потенциал металла по отношению к стандартному водородному потенциалу, принятому за нулевой уровень, тем легче металл отдает ионы в раствор, тем ниже его коррозионная стойкость. Значения электродного потенциала Е0 разных элементов приведены ниже
|
Элемент |
Мg |
Al |
Zn |
Cr |
Fe |
Co |
Ni |
|
Е0, В |
2,37 |
1,66 |
0,76 |
0,74 |
0,44 |
0,28 |
0,25 |
|
Элемент |
Sn |
Pb |
H |
Cu |
Hg |
Ag |
Au |
|
Е0, В |
0,14 |
0,13 |
0 |
+0,34 |
+0,79 |
+0,80 |
+1,50 |

Рис. 10.1. Схема электрохимического процесса
Ход электрохимического процесса определяется разностью потенциалов элемента. Для пары CuZn разность потенциалов составляет 1,1 В.
В случае замкнутой цепи медь является катодом, а цинк анодом, что приводит к его растворению. Если приложить напряжение более 1,1 В, то анод и катод поменяются местами, что приведет к растворению меди и восстановлению металлического цинка.
ВИДЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ (Ю.П. Солнцев)
Приведенная схема работы гальванической пары лежит в основе электрохимической коррозии металлов и сплавов. Разные фазовые составляющие, присутствующие в структуре сплава, находясь в электролите, приобретают разные по величине и знаку электродные потенциалы. Чем больше различие в электродных потенциалах отдельных фазовых составляющих, тем активнее будет протекать коррозионный процесс и коррозионное разрушение сплава. Электрохимическая гетерогенность поверхности металла является причиной коррозии. Более коррозионностойкими являются сплавы со структурой однородного твердого раствора.
Однако даже в случае однородной структуры коррозия может развиваться за счет образования анодных областей из-за наличия межкристаллитной пористости, различия остаточных напряжений в отдельных зернах и других факторов.
Особенно сильно электрохимическая коррозия развивается в случае контакта в конструкции разнородных материалов с разными потенциалами (например, коррозия стальных деталей в контакте с медными или магниевых сплавов в контакте со сталью).
Иллюстрацией могут служить две стальные пластинки, одна из которых покрыта оловом, а другая цинком (рис. 10.2). Нарушение этих пленок приводит к тому, что из-за разности электродных потенциалов железо в пластинке с оловом становится анодом, а в пластинке с цинком, наоборот, катодом. Цинк, разрушаясь, защищает железо от коррозии. Этим объясняется долговечность строительной жести, домашних ведер, оцинкованных кузовных листов и др.
Схемы основных разновидностей электрохимической коррозии приведены на рис. 10.3.
В случае однофазного материала, например чистого металла или однородного твердого раствора, коррозия распространяется равномерно по всей поверхности детали происходит так называемая общая или равномерная коррозия (рис. 10.3, а). Большинство коррозионно-стойких сталей хорошо сопротивляются равномерной коррозии в агрессивных средах. Высокая устойчивость сталей обусловлена их пассивным состоянием. Переход в пассивное состояние происходит самопроизвольно и связан с образованием на поверхности защитного субмикроскопического слоя с более высоким электродным потенциалом. Слой представляет собой сложный комплекс гидрооксидов. Состоянию пассивности способствует химическая устойчивость слоя в данном электролите и низкая проницаемость слоя для ионов.
В сталях пассивации способствует легирование хромом, содержание которого должно быть более 13 %.
При разрушении защитного слоя ионами Cl и
![]() коррозионностойкие
стали теряют пассивные свойства. В таких случаях вместо сталей целесообразно
использовать коррозионностойкие сплавы, например, никелевый сплав с 30 %
молибдена.
коррозионностойкие
стали теряют пассивные свойства. В таких случаях вместо сталей целесообразно
использовать коррозионностойкие сплавы, например, никелевый сплав с 30 %
молибдена.
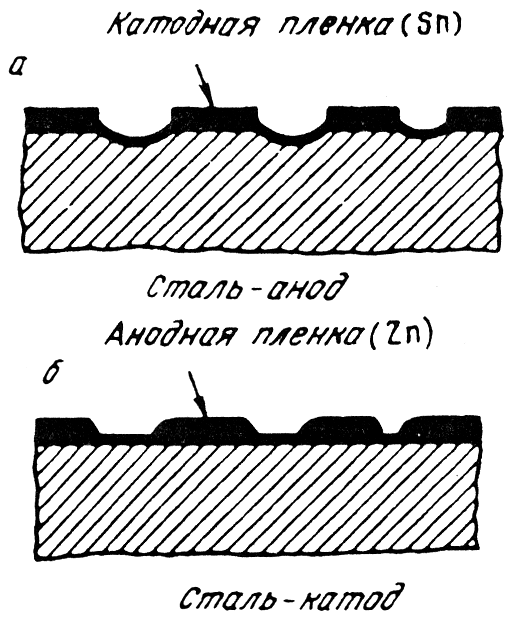
Рис. 10.2. Схема
коррозии при катодном (а) и анодном (б)
защитном покрытии
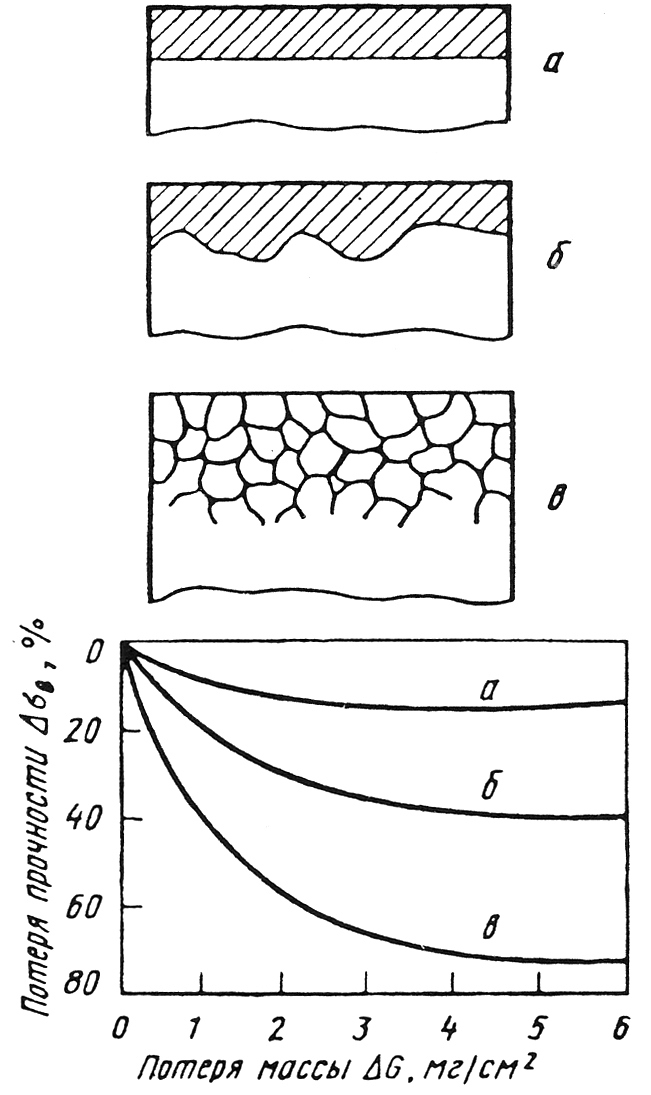
Рис. 10.3. Основные разновидности электрохимической
коррозии (схема) и их относительное влияние на
прочность листового дуралюмина:
а) равномерная коррозия; б)
местная коррозия;
в) межкристаллическая коррозия
Обработка, ведущая к гомогенизации структуры, делает сплав более устойчивым против электрохимической коррозии. Примером таких обработок является закалка хромоникелевой коррозионностойкой стали или отжиг оловянистых бронз, имеющих после литья неоднородное строение вследствие ликвации. Наоборот, нагрев сплавов, приводящий к распаду пересыщенного твердого раствора и выделению частиц второй фазы, снижает коррозионную стойкость. Разность потенциалов отдельных составляющих микроструктуры способствует электрохимической коррозии.
В неоднородных металлах коррозия носит местный характер, охватывая отдельные анодные участки их поверхности с низким значением электродного потенциала (рис. 10.3, б). К местной коррозии относятся питтинг или точечная коррозия, пятнистая и язвенная ее разновидности. Очаги местной коррозии являются концентраторами напряжений.
Анодными участками могут быть границы зерен и фаз, в то время как сами зерна являются катодами. В этом случае развивается наиболее опасный вид коррозии межкристаллитная коррозия (МКК). Она почти незаметна с поверхности и распространяется в глубь металла по границам зерен (рис. 10.3, в). В результате межкристаллитной коррозии нарушается связь между зернами, при постукивании по металлу пропадает характерный металлический звук, и после приложения нагрузки металл легко разрушается.
Межкристаллитная коррозия высокохромистой стали обусловлена выделением при повышенных температурах по границам зерен карбидов типа (Сr,Me)23С6 или Сr23С6. Эти карбиды образуются вследствие диффузии углерода из всего объема зерна, а хрома только с приграничных областей (рис. 10.4). Углерод перемещается по межузельному механизму диффузии (по механизму внедрения), который по сравнению с перемещением атомов по механизму замещения характеризуется высокой подвижностью. Это приводит к снижению содержания хрома в приграничных областях ниже его критической концентрации 1214 % и скачкообразному падению электродного потенциала с +0,2 до 0,6 В (рис. 10.5). Границы зерен становятся анодом по отношению к металлу внутри зерен.
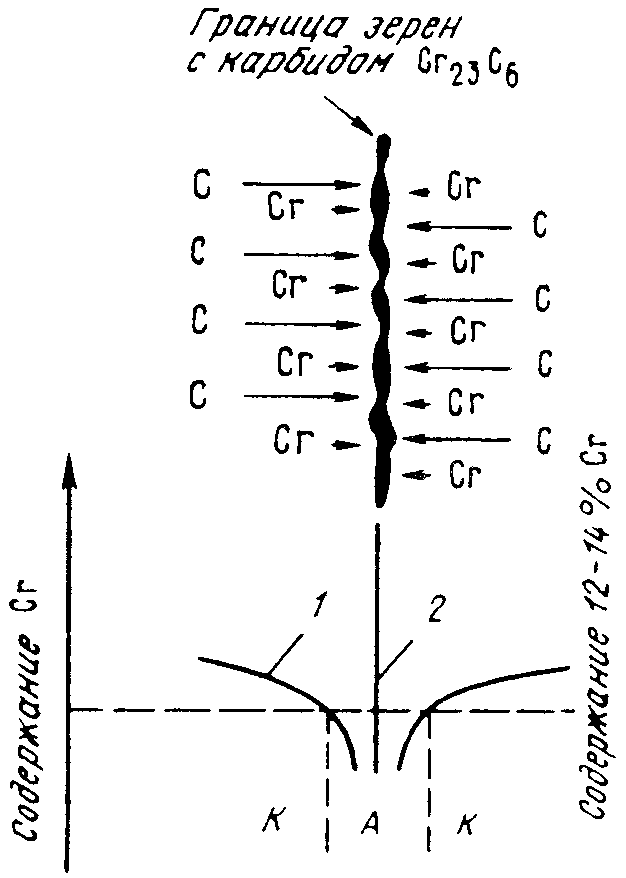
Рис. 10.4. Схема формирования межкристаллической
коррозии высокохромистой стали (стрелками указаны зоны диффузии хрома и
углерода):
Эффективным средством, подавляющим межкристаллитную коррозию высокохромистых сталей, является максимальное снижение содержания углерода и введение в сталь таких сильных карбидообразующих элементов, как титан или ниобий, обладающих бльшим сродством к углероду, чем хром.
При одновременном действии коррозионной среды и нагрузки или остаточных напряжений возникает коррозия под напряжением, проявляющаяся в виде коррозионного растрескивания или сетки трещин. Места концентрации напряжений имеют более низкий электродный потенциал и приобретают характер анодных участков.
Из жизненных ситуаций известно, что в поврежденных местах кузовов автомобилей, а также в местах деформаций, обведенных пунктиром на рис. 10.6, продукты коррозии появляются чаще всего. Высокие остаточные напряжения являются причиной ускоренной коррозии сварных швов, околошовной зоны, болтовых, заклепочных и других соединений.
Большое влияние на процесс коррозии в водных средах оказывает растворенный в жидкости кислород. При достаточном содержании кислорода на поверхности образуется защитная оксидная пленка, повышающая электродный потенциал металла. Наиболее опасные анодные зоны создаются в местах плохой аэрации, где затруднен доступ кислорода из воздуха. Хорошо известно, что та часть стальной плиты, которая находилась под слоем песка, корродирует в большей степени по сравнению с той частью, которая оставалась под непосредственным влиянием атмосферы. Стальные гвозди в старых деревянных конструкциях разрушаются гораздо быстрее, чем их головки, расположенные снаружи. Аналогичное явление наблюдается в щелях замкнутых профилей (пример пороги автомобилей), на стыке листов, на резьбовой поверхности в болтовых соединениях, на грязной поверхности и т. д. Примеры таких случаев представлены на рис. 10.7, а в табл. 10.1 представлены некоторые группы коррозионных пар.
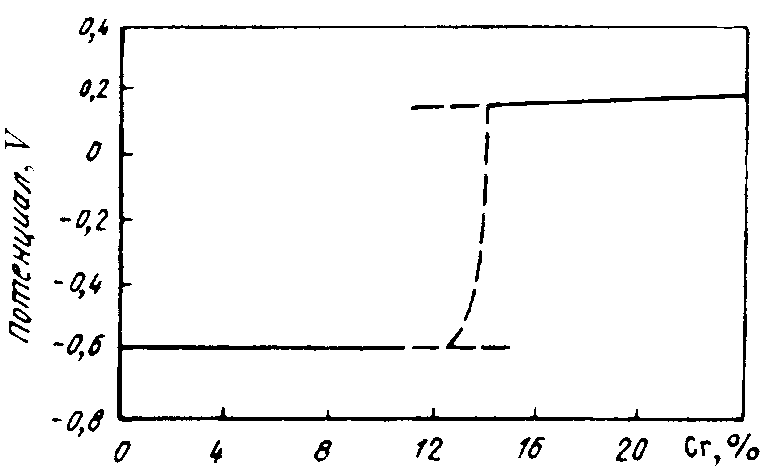
Рис. 10.5. Влияние содержания хрома на изменение электрохимического потенциала стали
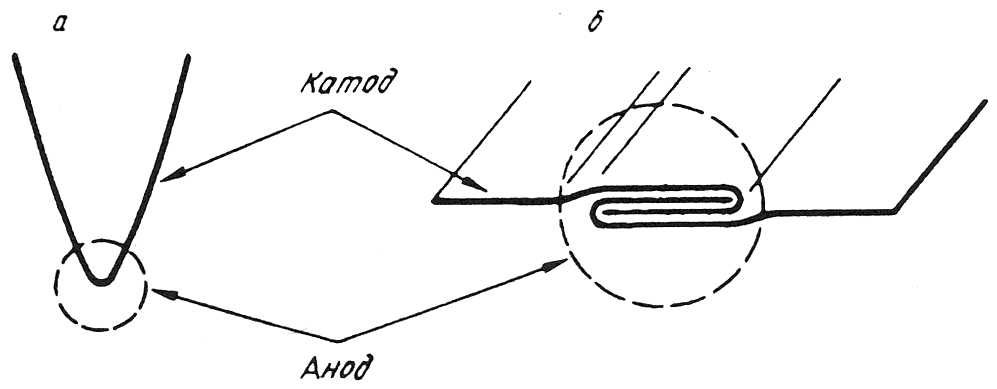
Рис. 10.6. Коррозионные пары, образовавшиеся
в результате деформации:
а) согнутый пруток; б)
соединение листов
Внутренние напряжения сами по себе не вызывают коррозии. Интенсифицируя это явление, они становятся инициаторами анодного процесса. Неоднородность внутренней структуры материала способствует коррозии. Коррозионные явления усиливаются при наложении анодной напряженности на структурную.
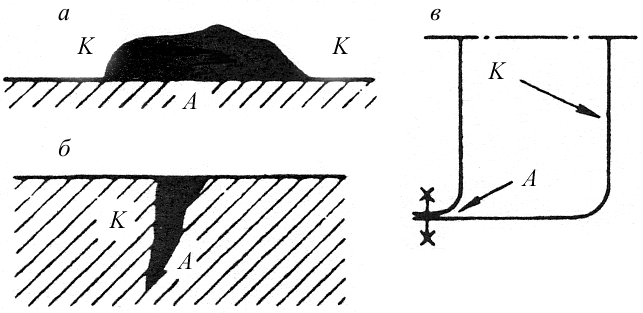
Рис. 10.7. Коррозионные пары, образовавшиеся при загрязнении поверхности стального листа (а), в устье трещины (б), в щели замкнутого профиля (в)
Таблица 10.1
Примеры коррозионных пар
|
Группа |
Коррозионная пара |
Анод |
Катод |
|
Коррозионные пары из двух различных материалов |
FeZn |
Zn |
Fe |
|
FeSn |
Fe |
Sn |
|
|
Перлит |
Феррит |
Цементит |
|
|
CuAl |
Al |
Сu |
|
|
Структурная и напряженная коррозионная пара |
Границы зерен |
Область с большей внутренней энергией |
Область с меньшей внутренней энергией |
|
Границы зерен |
Тело зерна |
||
|
Структурная и напряженная коррозионная пара |
Мелкие и крупные зерна |
Мелкие зерна |
Крупные зерна |
|
Дефекты структуры |
Дефекты |
Структура без дефектов |
|
|
Деформированные детали |
Зона деформации |
Недеформированная зона |
|
|
Напряженные болтовые, клепаные, сварные соединения |
Напряженные зоны |
Зоны, свободные от напряжений или с меньшими напряжениями |
|
|
Концентрационные коррозионные пары |
Различная концентрация электролита
|
Зона с меньшей концентрацией реагента |
Зона с большей концентрацией реагента |
|
Электролит с меньшей концентрацией |
Электролит с большей концентрацией |
||
|
Разная концентрация кислорода (доступ воздуха) Загрязненная поверхность |
Меньшая концентрация кислорода затруднен доступ воздуха |
Большая концентрация кислорода облегчен доступ воздуха |
|
|
Загрязненные или окисленные области |
Участки чистой поверхности |
Состав атмосферы также оказывает влияние на коррозию сплавов. В городах, где воздух загрязнен промышленными газами, коррозия проявляется значительно сильнее, чем в сельской местности. Для стальных деталей особенно вредными являются сернистый газ SO2, сероводород H2S, хлор Сl2 и хлористый водород НС1. Хлористый водород также опасен для алюминиевых и магниевых сплавов. Для медных сплавов характерна повышенная коррозия в атмосфере аммиака NН3.
По повышению коррозионной агрессивности различные виды атмосфер могут быть расположены в следующий ряд: сухая континентальная, морская чистая, морская индустриальная, индустриальная, индустриальная сильно загрязненная.
Коррозионная усталость. Это процесс постепенного накопления повреждений материала под действием переменных напряжений и коррозионно-активных сред. Образование и развитие усталостных трещин сопровождается проникновением коррозионной среды в эти трещины и облегчает разрушение. Этому виду разрушения подвержены практически любые конструкционные материалы на основе железа, алюминия, титана, меди и других металлов. Особая опасность коррозионно-усталостного разрушения состоит в том, что оно может проходить практически в любых, в том числе таких слабых коррозионных средах, как влажный воздух, газы, влажные машинные масла и др. Поэтому коррозионная усталость металлов и сплавов наблюдается во всех отраслях техники, прежде всего в энергетической, нефтегазодобывающей, горнорудной промышленности, в морском, наземном и воздушном транспорте.
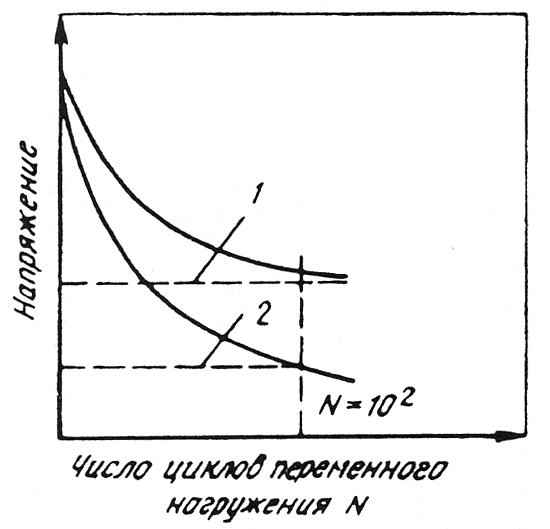
Рис. 10.8. Диаграмма усталости:
1 предел усталости
(истинный); 2 предел коррозионной усталости (условный при N = 107)
При коррозионно-усталостном нагружении разрушение может произойти при напряжениях, значительно меньших обычного предела усталости (рис. 10.8). При этом кривая коррозионной усталости стремится к оси абсцисс, а величина условного предела усталости приближатеся к нулевому значению. Объясняется это тем, что даже при минимальных напряжениях или их отсутствии недостаточно защищенный металл разрушится только от коррозии. Прогрессирующий рост трещин усталости обусловлен, с одной стороны, низким значением электродного потенциала в месте концентрации напряжений, а с другой легким разрушением защитной оксидной пленки в устье трещины при переменном нагружении.
ОЦЕНКА КОРРОЗИОННОЙ СТОЙКОСТИ (Ю.П. Солнцев)
Для характеристики коррозионных свойств материалов обычно проводят их испытания на стойкость против общей коррозии, межкристаллитной коррозии и коррозионного растрескивания.
Испытания на общую коррозию. Испытания на общую коррозию проводят на образцах с большим отношением поверхности к объему. Коррозионную среду выбирают с учетом условий эксплуатации материала. Испытания проводят в жидкости при постоянном или многократно повторяемом переменном нагружении образцов в кипящем соляном растворе, в парах или окружающей атмосфере.
В России, США и ФРГ применяют пятибалльную систему оценки общей коррозии (табл. 10.2). Критерием коррозионной стойкости является скорость коррозии (vкор, мм/год).
Таблица 10.2
Пятибалльная шкала коррозионной стойкости металлов
|
Балл |
Скорость коррозии vкор, мм/год |
Категория стойкости |
|
1 |
Не более 0,10 |
Сильностойкие |
|
2 |
0,101,00 |
Стойкие |
|
3 |
1,103,00 |
Пониженностойкие |
|
4 |
3,1010,0 |
Малостойкие |
|
5 |
Более 10,0 |
Нестойкие |
Кроме глубины проникновения, оценку коррозионной стойкости можно проводить по десятибалльной шкале потери массы образца за определенный период времени на единицу площади K, г / (м2 · ч).
Пересчет обоих показателей проводят по формуле
![]()
где vK скорость коррозии, мм/год; γ плотность, г/см3; gK потеря массы образца, г/(м2 · ч).
Испытания на межкристаллитную коррозию (ГОСТ 603284). Основной причиной межкристаллитной коррозии коррозионностойких материалов является нагрев при обработке давлением или сварке, приводящий к электрохимической гетерогенности между приграничными участками и объемом зерен.
Температурно-временная область выделения по границам зерен коррозионностойких сталей карбидов хрома приведена на рис. 10.9. Внутри нее находится область сенсибилизации повышенной чувствительности к межкристаллитной коррозии. Склонность к межкристаллитной коррозии проявляется в температурном интервале Тmax Тmin за минимальное время τmin, в течение которого происходит сенсибилизация.
При испытаниях на МКК хромистые стали подвергают провоцирующему нагреву при температуре 1 100 °С в течение 30 ч, а хромоникелевые аустенитные при температуре около 700 °С в течение до 60 ч. После нагрева образцы выдерживают в течение длительного времени в кипящем водном растворе серной или азотной кислоты. Выбор длительности выдержки и вида коррозионной среды зависит от конкретной марки стали и ее назначения.
Для контроля склонности к МКК образцы либо изгибают на оправке на угол 90°, либо подвергают травлению специальными реактивами и металлографическому исследованию. Отсутствие трещин на поверхности образца свидетельствует о его стойкости к МКК.
На рис. 10.10 приведены микроструктуры стали 08Х18Н10 после испытаний на межкристаллитную коррозию в разных средах.
Участки зон в сварных соединениях и термического влияния в стабилизированных сталях не теряют стойкости к МКК. Однако коррозионное разрушение может происходить по основному металлу вблизи поверхности его сплавления с металлом шва. По обе стороны сварного шва могут подвергаться разрушению зоны шириной менее 0,1 мм. Эту разновидность МКК называют ножевой коррозией. Ножевая коррозия образуется вследствие растворения карбидов Ti и Nb в узкой зоне аустенита при сварке и выделения дисперсных частиц этих карбидов и карбидов Cr по границам зерен аустенита во время охлаждения сварного соединения.
Растрескивание происходит, если растягивающие напряжения превышают критическое значение σкр (обычно σкр ≈ σ0,2), а в электролите присутствует активатор, разрушающий пассивное состояние металла (например Cl).
Коррозионное растрескивание представляет собой разрушение металла при одновременном действии коррозионно-активной среды и растягивающих напряжений.
Испытания на коррозионное растрескивание. Этот вид испытаний проводят при нагружении образца в коррозионной среде, соответствующей служебным условиям эксплуатации детали. Среда не должна вызывать общей коррозии и оказывать воздействие на ненагруженные образцы металла. Для аустенитных хромоникелевых сталей примером такой среды может служить кипящий раствор смеси солей MgCl2, NaCl и NaNO3. Агрессивность сред должна быть не меньше той, в которой должны служить испытуемые материалы.
Ферритные стали имеют максимальную стойкость к коррозионному растрескиванию, а аустенитные минимальную (табл. 10.3)
.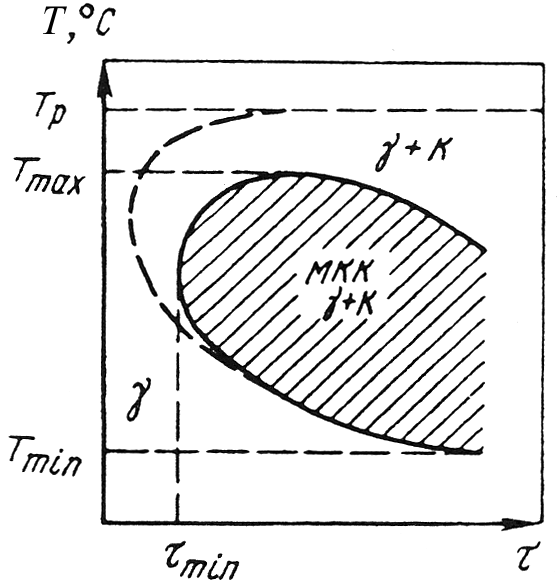
Рис. 10.9. Температурно-временная область склонности
коррозионностойкой аустенитной
стали к межкристаллитной коррозии (МКК), связанной с объединением границ
зерен по хрому; Тр температура растворения карбидов;
γ аустенит;
К карбиды
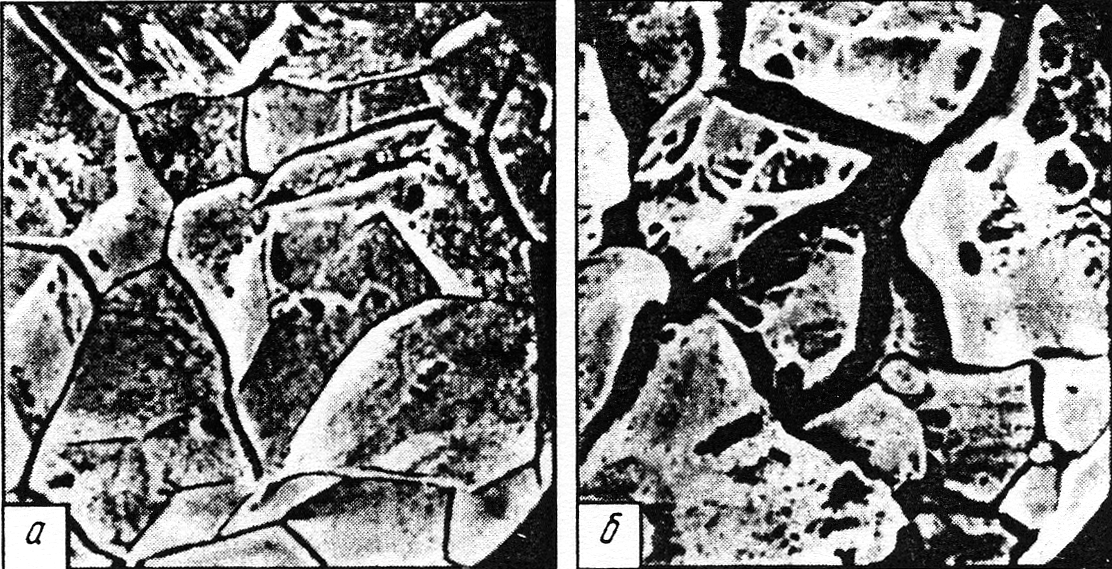
Рис. 10.10. Микроструктура стали 08Х18Н10 после
закалки с 1050 °С в воде и отпуска при 700 °С:
а) межкристаллитная коррозия
при испытании в растворе 25%-ной HNO 3 + 40 г/л Cl 6+,
продолжительность 200 ч;
б) то же в растворе кипящей 65 %-ной HNO 3 + Cl 6+.
×500
Таблица 10.3
Прочность и сопротивление коррозионному растрескиванию коррозионностойких сталей
|
Марка стали |
Класс |
σв |
σ0,2 |
σкр |
|
МПа |
||||
|
08Х17Т |
Ферритный |
400 |
280 |
350 |
|
15Х25Т |
То же |
470 |
320 |
450 |
|
08Х18Н10Т |
Аустенитный |
450 |
220 |
150 |
|
10Х14Г14Н4Т |
То же |
430 |
180 |
100 |
|
10Х17Н13М2Т |
То же |
500 |
240 |
170 |
|
08Х22Н6Т |
Аустенитно-ферритный |
520 |
350 |
350 |
|
08Х21Н6М2Т |
То же |
550 |
360 |
210 |
|
08Х18Г8Н2Т |
То же |
540 |
350 |
450 |
Испытания на коррозионное растрескивание могут проводиться либо в условиях, вызывающих разрушение материалов (испытания на растяжение, на вязкость разрушения и усталость), либо путем определения времени появления первой трещины. Последний вид испытаний состоит в фиксации нагруженных образцов в специальных приспособлениях или с помощью создания напряжений клином в разрезанных кольцах (рис. 10.11). Время до появления трещин характеризует стойкость материалов против коррозионного растрескивания.
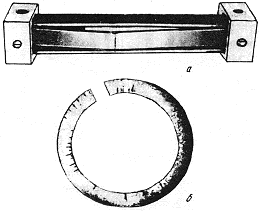
Рис.10.11. Испытание на коррозионное растрескивание в
струбцине (а) и на кольцах (б) с клином для
определения времени до образования
коррозионных трещин
МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ (Ю.П. Солнцев)
Многообразие процессов электрохимической коррозии и условий ее проявления обусловили широкий диапазон способов защиты от этого явления. Многое зависит от конструкции изделия. Конструктор-проектировщик первым должен предусмотреть защиту от коррозии. Он должен рационально подобрать материалы и так спроектировать конструкцию, чтобы максимально ограничить влияние неизбежных анодных областей и появление таких областей в ходе эксплуатации.
Методы защиты от коррозии можно объединить в следующие группы:
1. Нанесение защитных покрытий и пленок.
2. Изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз.
3. Модификация коррозионной среды.
Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом. Его эффективность зависит не только от выбора подходящего покрытия, но и от соответствующей обработки поверхности материала. Она должна быть очищена от органических загрязнений, таких как масла и смазки, а также от ржавчины, окалины и т. п. В связи с этим подготовка поверхности состоит в мытье, обезжиривании, механической очистке шлифованием, полированием, очистке щетками или дробеструйной обработке. Чистую поверхность металла получают также химическим или электролитическим травлением в растворах кислот.
В качестве защитных применяют металлические и неметаллические покрытия.
Металлические покрытия могут быть выполнены из металла более или менее благородного, чем подложка. В связи с этим они делятся на две группы: катодные и анодные покрытия.
К катодным покрытиям относятся те покрытия, электрохимический потенциал которых в данных условиях больше, чем у защищаемого металла. На алюминий почти всегда наносят катодные покрытия. Покрытия из благородных металлов на стали имеют такой же характер. Катодные покрытия защищают металл только благодаря его изоляции от атакующей среды. Поэтому свою роль они выполняют только при наличии полной сплошности. Если в катодном покрытии образуется щель, то в условиях коррозии она становится катодом, а открытая часть защищаемого металла анодным элементом. Анодная поверхность при этом значительно меньше, чем катодная. Электрохимическое разрушение металла концентрируется на небольшой поверхности. Учитывая опасности, кроющиеся в возможных несплошностях катодных покрытий, их делают сравнительно большой толщины.
Схематически этот вид разрушения показан на рис. 10.2, а.
Анодные покрытия это покрытия, выполненные из металла с меньшим электродным потенциалом, чем у защищаемого металла. Для железа, работающего в малокислых или нейтральных растворах, анодными покрытиями являются цинк, кадмий, алюминий. Защитные свойства анодных покрытий состоят не только в механической изоляции металла от коррозионной среды, но и в электрохимическом воздействии. В случае нарушения покрытия и образовании коррозионного элемента, защищаемый металл, являющийся катодом, не разрушается. Небольшие несплошности в анодных покрытиях не опасны (рис. 10.2, б).
Металлические покрытия наносят электроосаждением, погружением в расплавленные металлы, металлизацией напылением, химическим осаждением солей, диффузией и т. д. В последнее время все большее распространение получает нанесение покрытий в вакууме. В этом случае покрытия получают испарением металлов в вакууме с последующей конденсацией паров на защищаемой поверхности. Этим способом производят алюминирование, кадмирование и цинкование в вакууме стальных деталей.
Неметаллические покрытия применяются в случае возникновения химической реакции металла в соответствующих средах. К ним, в частности относят оксидные алюминиевые покрытия, полученные в ходе специального электролитического процесса. Фосфатные покрытия применяются в большинстве случаев с дополнительными защитными средствами, как, например, красками, лаками и т. п. Фосфатирование стали состоит в погружении изделия в разбавленный раствор фосфорной кислоты и кислых фосфатов цинка или магния. В результате реакции образуется нерастворимый фосфат железа, который в ходе процесса плотно покрывает поверхность металла. К этой же группе относят керамические покрытия и стекловидные эмали. Эти покрытия достаточно стойкие к воздействию минеральных и органических кислот. Их недостатком является повышенная хрупкость и низкая стойкость в условиях резких перепадов температуры.
Органические покрытия выполняются с помощью разнообразных лакокрасочных материалов.
Знание механизма коррозии позволило создать методы коррозионной защиты путем наложения на металл такого потенциала, при котором он становится термодинамически устойчивым. К таким методам относятся катодная защита и уменьшение агрессивности среды, окружающей металлоконструкцию.
Катодная зашита состоит в присоединении к защищаемой конструкции анода протектора с более отрицательным электрохимическим потенциалом. Протектор (от слова «protection» защита) и служит таким анодом, препятствующим разрушению защищаемого сплава; сам протектор при коррозии постепенно разрушается.
Протектором может являться любой металл, имеющий по отношению к данному сплаву более отрицательный потенциал. Однако разница в потенциалах не должна быть слишком большой, чтобы при электрохимическом процессе не происходило быстрого разрушения протектора.
Протекторы представляют собой обычно небольшие пластинки, присоединяемые к защищаемой детали заклепками или болтами. Катодную или протекторную защиту широко используют при защите от морской и подземной коррозии металлоконструкций, коммуникаций, трубопроводов, сосудов и т. д. В качестве анодов-протекторов для защиты стальных изделий обычно применяют сплавы магния или цинка. Защита может также осуществляться присоединением защищаемого металла к отрицательному полюсу постоянного тока. На рис. 10.12 приведены примеры катодной защиты.
Для уменьшения агрессивности окружающей среды в нее вводят добавки, называемые ингибиторами коррозии, которые или способствуют пассивации металла, или значительно снижают скорость коррозии металлов. Условием использования ингибиторов является эксплуатация изделия в замкнутой среде постоянного состава.
Различают анодные и катодные ингибиторы. В качестве анодных ингибиторов коррозии используют различные вещества, образующие нерастворимые соединения на анодных участках. Одним из таких пассиваторов является хромпик K2Сr2О7, вводимый в количестве 23 г/л раствора охлаждающей жидкости.
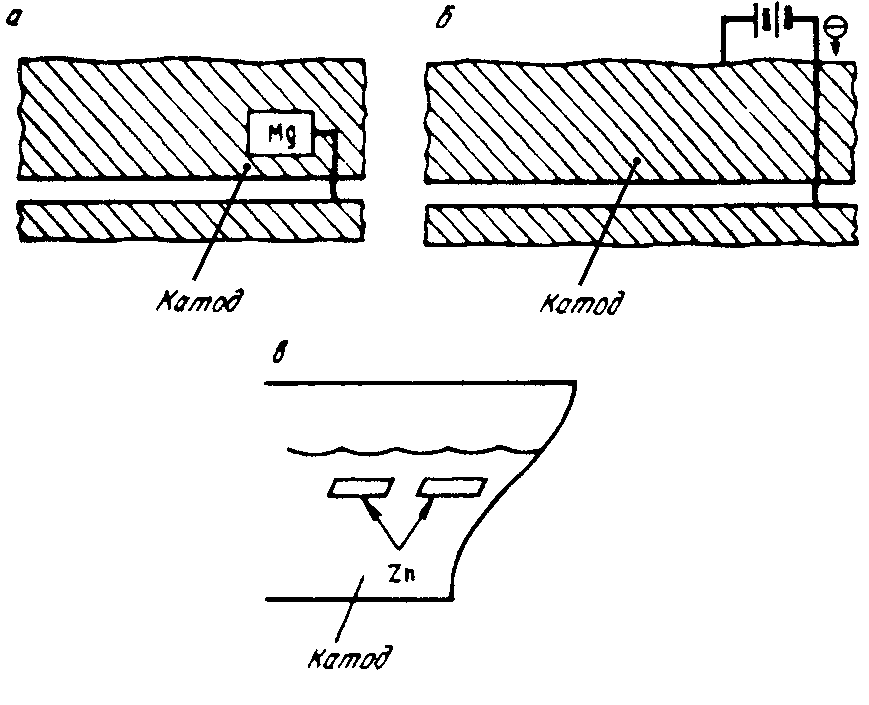
Рис. 10.12. Примеры катодной защиты стали:
а) катод сталь, анод Zn
или Mn;
б) защита присоединением к источнику постоянного тока;
в) протекторная защита корпуса корабля
Катодные ингибиторы тормозят катодный процесс. К их числу относятся различные травильные присадки, добавляемые в количестве 12 % в кислоты для снятия окалины без разрушения основного металла.
Летучие ингибиторы такие, как нитрат натрия NaNO2, применяют для пропитки бумаги, в которую заворачивают детали, подлежащие хранению или транспортировке. Испаряясь, они насыщают окружающее детали пространство и создают защитную газовую среду. Летучие ингибиторы характеризуются высокой эффективностью. Стальные изделия, завернутые в бумагу, обработанную NaNO2 в условиях относительной влажности 85 %, не ржавеют в течение 5 лет. Преимуществом летучих ингибиторов является отказ от применения защитных покрытий, удобство расконсервации и постоянная готовность деталей к немедленному использованию без дополнительной обработки.
ХРОМИСТЫЕ СТАЛИ МАРТЕНСИТНОГО, МАРТЕНСИТНО-ФЕРРИТНОГО И ФЕРРИТНОГО КЛАССОВ (Н.С. Самойлов)
Стойкость сталей и сплавов этого класса против электрохимической, химической коррозии (атмосферной, почвенной, щелочной, кислотной, солевой), межкристаллитной коррозии, коррозии под напряжением и др. определяется в первую очередь их составом.
Однако большое влияние на служебные свойства сталей и сплавов оказывают также термическая обработка, сварка, горячая пластическая деформация, качество поверхности металла и другие факторы.
В зависимости от основной структуры, полученной при охлаждении на воздухе после высокотемпературного нагрева, эти стали и сплавы подразделяют на следующие классы:
1) мартенситный стали с основной структурой мартенсита (хромистые стали с 1217 % Cr, содержащие более 0,15 % С и, специальные добавки Мо, W, V и небольшое количество Ni до 3 %);
2) мартенситно-ферритный стали, содержащие в структуре кроме мартенсита не менее 10 % феррита (хромистые стали с 1318 % Cr и низким содержанием С до 0,15 %, в ряде случаев с добавками Al, Ti, Ni, Si);
3) ферритный стали, имеющие структуру феррита без α ↔ γ-превращений (хромистые стали с 1330 % Cr, низким содержанием С до 0,15 %, добавками Ti ≥ 0,5 %, иногда также Nb, Si, Mo, Al).
Коррозионностойкие хромистые стали можно разделить на три группы: с фазовым превращением (мартенситный класс); с частичным фазовым превращением (мартенситно-ферритный класс); без фазовых превращений (ферритный класс).
Механические, физические, коррозионные и технологические свойства, а в соответствии с этим и области применения хромистых сталей зависят от их химического состава и структуры (табл. 10.4, 10.5).
Таблица 10.4
Химический состав (%) хромистых коррозионностойких сталей (ГОСТ 563272)
|
Сталь |
С |
Si |
Mn |
Сr |
Ni |
Ti |
Nb |
S |
P |
|
|
Не более |
Не более |
|||||||||
|
Стали мартенситного класса |
||||||||||
|
20Х13 |
0,160,25 |
0,8 |
0,8 |
12,014,0 |
|
|
|
0,025 |
0,030 |
|
|
30Х13 |
0,260,35 |
0,8 |
0,8 |
12,014,0 |
|
|
|
0,025 |
0,030 |
|
|
40Х13 |
0,360,45 |
0,8 |
0,8 |
12,014,0 |
|
|
|
0,025 |
0,030 |
|
|
25Х13Н2 |
0,200,30 |
0,5 |
0,81,2 |
12,014,0 |
1,52,0 |
|
|
0,150,25 |
0,080,15 |
|
|
20Х17Н2 |
0,170,25 |
0,8 |
0,8 |
16,018,0 |
1,52,50 |
|
|
0,025 |
0,035 |
|
|
95Х18 |
0,091,00 |
0,8 |
0,8 |
17,019,0 |
|
|
|
0,025 |
0,030 |
|
|
09Х16Н4Б |
0,050,13 |
0,6 |
0,5 |
15,018,0 |
3,54,5 |
|
0,050,20 |
0,025 |
0,030 |
|
|
Стали мартенситноферритного класса |
||||||||||
|
12Х13 |
0,090,15 |
0,8 |
0,8 |
12,014,0 |
|
|
|
0,025 |
0,030 |
|
|
14Х17Н2 |
0,140,17 |
0,8 |
0,8 |
16,018,0 |
1,52,5 |
|
|
0,025 |
0,030 |
|
|
Стали ферритного класса |
||||||||||
|
08Х13 |
≤ 0,08 |
0,8 |
0,8 |
12,014,0 |
|
|
|
0,025 |
0,030 |
|
|
12Х17 |
≤ 0,12 |
0,8 |
0,8 |
16,018,0 |
|
|
|
0,025 |
0,035 |
|
|
08Х17Т |
≤ 0,08 |
0,8 |
0,8 |
16,018,0 |
|
5 · С0,8 |
|
0,025 |
0,035 |
|
|
15Х25Т |
≤ 0,15 |
1,0 |
0,8 |
24,027,0 |
|
5 · С0,9 |
|
0,025 |
0,035 |
|
|
15Х28 |
≤ 0,15 |
1,0 |
0,8 |
27,030,0 |
|
|
0,025 |
0,035 |
||
Таблица 10.5
Характеристики механических свойств и режимы термической
обработки хромистых
коррозионностойких сталей мартенситного, мартенситно-ферритного и ферритного
классов
|
Сталь |
Режим термической обработки, |
σВ |
σ0,2 |
δ5 |
ψ |
КСU, Дж/см2 |
|
МПа |
% |
|||||
|
Не менее |
||||||
|
08Х13 |
Закалка,10001050, масло; отпуск, 700800, масло |
600 |
420 |
20 |
60 |
100 |
|
12Х13 |
Закалка,10001050, воздух или масло; отпуск, 700900,воздух, масло или вода |
600 |
420 |
20 |
60 |
90 |
|
20Х13 |
Закалка,10001050, воздух или масло; отпуск, 660770, воздух, масло или вода |
660 |
450 |
16 |
55 |
80 |
|
30Х13 |
Закалка 9501020, масло; отпуск, 200300, воздух или масло |
Твердость HRCЭ ≥ 48 |
||||
|
40Х13 |
Закалка, 10001050, масло; отпуск, 200300, воздух или масло |
Твердость HRC ≥ 50 |
||||
|
14Х17Н2 |
Закалка, 9751040, масло; отпуск, 275350, воздух |
1100 |
850 |
10 |
30 |
50 |
|
Закалка, 9751040, масло; отпуск, 500530, воздух |
1200 |
900 |
12 |
62 |
40 |
|
|
20Х17Н2 |
Закалка, 9751050, масло; обработка холодом, 70, отпуск, 275350, воздух |
1500 |
1250 |
7 |
|
30 |
|
95Х18 |
Закалка, 10001050, масло; отпуск, 200300, воздух или масло |
Твердость HRC ≥ 55 |
||||
|
09Х16Н4Б |
Закалка, 10301050, воздух или масло; отпуск, 600620, воздух |
1200 |
900 |
8 |
40 |
60 |
|
Закалка, 970980, воздух или масло; отпуск, 300370, воздух |
Высокая стойкость против коррозии |
|||||
|
12Х17 |
Отжиг, 760780, воздух или вода |
400 |
250 |
20 |
50 |
|
|
08Х17Т |
Отжиг, 760780, воздух |
500 |
300 |
20 |
45 |
|
|
15Х25Т 15Х28 |
Отжиг, 680770, воздух или вода; без термической обработки |
450 |
300 |
20 |
45 |
|
Эти стали применяют в различных отраслях промышленности: для клапанов гидравлических прессов, турбин, лопаток, арматуры крекинг-установок, карбюраторных игл, шарикоподшипников и втулок для нефтяного оборудования, режущего, мерительного и хирургического инструмента, оборудования заводов пищевой и легкой промышленности, предметов домашнего обихода и кухонной утвари и др.
Широкое практическое применение получили следующие хромистые коррозионностойкие стали:
1) Хромистые стали мартенситного класса 20Х13, 30Х13, 40Х13. В этих сталях содержится ~ 13 % Cr, что соответствует минимальному его содержанию, обеспечивающему повышенную коррозионную стойкость. Эти стали применяют преимущественно в термически обработанном состоянии, часто с тщательно шлифованной, а иногда и полированной поверхностью.
Структура и свойства этих сталей в значительной степени зависят от содержания в них углерода: с понижением содержания углерода в этих сталях появляется структурно свободный феррит, ухудшающий механические свойства, и они переходят из мартенситного в мартенситно-ферритный (сталь 12Х13) и даже чисто ферритный (сталь 08Х13) классы; коррозионная стойкость их при этом несколько повышается. С повышением содержания углерода снижается коррозионная стойкость, увеличивается твердость, но возрастает хрупкость.
2) Хромоникелевая сталь 20Х17Н2 мартенситного класса, имеет более высокие механические свойства и коррозионную стойкость, чем у 13%-ных хромистых сталей; эта сталь хорошо поддается горячей и холодной штамповке, обрабатывается резанием, сваривается всеми видами сварки; твердость поверхностного слоя изделий из стали 20Х17Н2 при необходимости можно повысить до HRCЭ 5860 путем газового цианирования или цементации.
3) 17%-ные хромистые стали ферритного класса 12Х17 и 08Х17Т применяются в отожженном состоянии; у этих сталей удовлетворительная пластичность в горячем и в холодном состоянии; однако вследствие пониженной пластичности сварных соединений, связанной с ростом зерна в зонах, прилегающих к сварному шву, в результате воздействия высоких температур при сварке и пониженной коррозионной стойкости зон, расположенных вблизи сварных швов, изделия из этих сталей изготовляют преимущественно без применения сварки; введение в 17%-ную хромистую сталь Ti, связывающего углерод в карбиды (TiC), способствует повышению сопротивляемости межкристаллитной коррозии (сталь 08Х17Т).
4) Высокохромистые стали ферритного класса 15Х25Т, 15Х28Т обладают высокой стойкостью в сильно-агрессивных средах; ввиду повышенной склонности этих сталей к росту зерна необходимо, чтобы начало прокатки было при температуре не выше 1000 1020 °С и чтобы скорость сварки и охлаждения сварного шва и околошовной зоны была по возможности высокой; соблюдение этих условий также способствует повышению стойкости сталей к межкристаллитной коррозии.
Высокохромистые стали при нагреве в интервале температур 400500 °С склонны к охрупчиванию, которое проявляется в снижении ударной вязкости, относительного удлинения и в росте твердости.
 |